在2013~2017年专利悬崖的冲击下,新药上市速度锐减。与此同时,各国纷纷出台政策支持仿制药发展,未来仿制药市场规模将显著扩容。到2017年,仿制药市场占比将提高到36%。
由于各国对仿制药、专利药的政策导向不同,仿制药在新兴市场以58%的份额占据统治地位,而发达市场占比仅16%。
美国
印象:其他国家学习的典范,仿制药份额:90%

美国作为全球最发达的医药市场,在平衡专利药与仿制药方面虽不能说做得尽善尽美,但也当之无愧成为其他国家学习的典范。以药品数量计算,其仿制药占比近年来趋于稳定,2008~2013年,仿制药在美国市场占比在90%上下波动。仅2012年一年,仿制药的使用为美国节省了约2170亿美元的医疗开支;2003~2012年的十年间,仿制药的使用为美国节省了超过12000亿美元的医疗开支。受专利到期影响,预计2014~2016年,美国平均每年会有400亿美元的专利药销售额转化为仿制药。
30年前,美国FDA通过了一项里程碑式的法案--药品价格竞争与专利期补偿法案,即著名的《Hatch-Waxman法案》,并在2003年做出修订。该法案的实施使得政府在鼓励仿制药开发和专利保护之间达成平衡;其首次引入了简化新药审批程序(ANDA),为仿制药企节省审批时间和仿制药开发费用。2007年,美国FDA实施“仿制药药物价值和有效性项目”(GIVE),进一步加大了对仿制药的支持力度。
另一个促使仿制药在美国保持霸主地位的原因是美国人对仿制药的接受认可程度高。美国医生所开处方都以通用名药为主,即使开出品牌药的药方,病人到药店取药时,药剂师也会自动转为仿制药,除非医生坚持用品牌药或是病人愿意自己额外买单。
日本
印象:宁愿花更多钱买品牌药,仿制药份额:22.8%
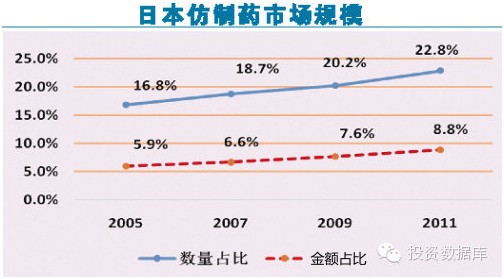
自1961年实施全民医疗保险政策以来,日本已成为全世界平均寿命最长的国家,而且也荣登医疗保险金额最高国家的宝座。然而,随之而来的问题是严重的人口老龄化以及吃紧的医疗财政支出。另一方面,尽管日本医药市场规模在2012年已达到1113亿美元,位居世界医药市场第二把交椅。但是,日本人对产品质量的要求很高,这一点在医药产品中尤为突出。他们根深蒂固地认为,廉价的仿制药质量要比品牌药差,所以他们宁愿花更多的钱去买品牌药,也不愿意花少量的钱去买疗效相差无几的仿制药。这一民族习惯使得日本医药市场构成明显有别于其他医药市场。
若以药品数量计算,大部分国家仿制药份额都超过50%,然而日本仿制药市场一直保持较低的水平,2002年左右,日本开始实行《基于诊断程序联合的全面评估》,部分医院为减少支出,加大了对仿制药的使用力度,但收效并不明显。
2005年,仿制药占日本医药市场的16.8%。2007年,日本厚生劳动省公布《促进通用名药用药安全行动计划》,提出到2012年仿制药市场份额要达到30%的目标。据估算,如果达成这一目标,5年内将为日本节省约5000亿日元的医疗开支。最新数据显示,2011年,仿制药比例上升至22.8%。由此估算,到2013年,日本已经基本达成这一目标。
可以看到,日本在降低医疗财政支出方面做了很多的努力,但是改变日本人对仿制药的态度,对外来仿制药企(尤其是印度、中国仿制药企)的成见,才是其提高仿制药市场份额、减少政府医疗开支的关键。
印度
仿制药生产强国,仿制药份额:90%
过去的40年间,印度医药工业发生了翻天覆地的变化,从不知医药产业为何物的初生牛犊,发展成当今世界领先的仿制药生产强国。有数据显示,2011年,印度医药市场中,仿制药为处方销售额的贡献率高达90%。
1970年,印度出台专利法,放开对过去英殖民时代的专利保护,大批印度当地药企纷纷仿制国外受专利保护的药品,印度医药工业借此契机飞速发展。2005年,印度医药市场80%的市场份额被本土仿制药企业瓜分。但印度1995年加入WTO,不得不在2005年出台专利法修正案,提出1995年1月1日后的专利受印度专利法保护。
不过,印度已经孕育出多家世界级的仿制药企,如RanbaxyLabs,Dr.Reddy’s,Cipla,Wockhardt,SunPharma等。这些世界级的仿制药企通过多年的打拼,积累了丰富的资本、经验,为此后大举进军欧美市场铺平了道路。
欧洲
欧债危机下政策偏爱仿制药,仿制药份额:18%
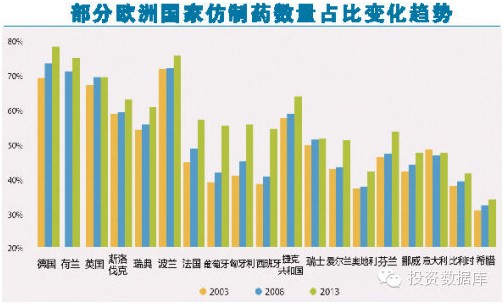
欧洲仿制药协会(EGA)于2011年估算,仿制药每年为欧盟节省约300亿欧元的医疗开支。而随着欧盟的不断扩大,这一节省的支出数字很可能翻倍。按药品数量计算,一半以上的欧洲市场已被仿制药占据,但是以金额计算,仿制药占比仅为18%。
欧洲的许多国家很早便纷纷出台政策加大对仿制药的支持力度。类似于美国的《Hatch-Waxman法案》,欧洲国家在新药品法中加入“Bolar条款”,并引入“药房替代”的概念。
此外,英国2005年将常用处方仿制药归类为“M类”,以确保促进价格竞争;2010年英国卫生部开始对在初级医疗保健领域提高仿制药使用率征求意见,意欲将仿制药处方率从83%提高到88%,期望每年节省大约4900万英镑开支。德国于2006年推出“医疗经济最优化”法案(AVWG),旨在通过鼓励使用通用名药来降低处方药的整体价格。希腊也于2011年引入药品支出遏制措施,提出加强对仿制药的使用率。
2008年后,欧债危机下欧洲各国财政紧缩,部分国家通过大幅提高仿制药的使用比例,从而降低医疗财政支出。法国、葡萄牙、匈牙利、西班牙等欧洲国家便是使用这一手段的典型国家,这4个国家2013年仿制药市场占有率较2008年有明显上升。
欧债危机使得欧洲元气大伤,总体来讲,目前欧洲的政策“天平”偏向于仿制药。未来五年内,欧洲经济从危机阴影中走出,老龄化问题将继续加剧,生物药品纷纷坠落专利悬崖,新药研发陷入瓶颈期,各种利弊因素交织在一起。未来欧洲的政策“天平”偏向何方,我们只能拭目以待。
中国仿制药使用大国,仿制药份额:95%
2012年,中国的医药市场规模为817亿美元。以药品数量计算,保守估计,中国仿制药份额在95%左右,堪称仿制药使用大国。但是,我国仿制药的市场准入制度还需进一步完善和修改,尤其是对临床亟需和国家重大需求的仿制药品种建立优先审评制度方面仍需努力。
目前,我国仿制药申请的一大特点是:低水平、高重复的仿制药申请占比高。CDE统计数据显示,2013年新申报的仿制及改剂型申请共2427个(按受理号计)。其中,已有批准文号20个以上的药品有1039个申请,占比为42.8%(2012年为60.7%);而已有批准文号在10个以内的仿制及改剂型申请932个,占38.4%(2012年为20.6%)。
FDA曾对美国1999~2004年仿制药价格与仿制药生产厂家的数量关系做过一个统计,结果显示,当仿制药生产厂家只有两家时,仿制药价格为原研药的52%;当生产厂家数目至10家时,其价格降至原研药的26%;当生产厂家数目接近20时,仿制药的价格仅为原研药的6%。在中国,一个仿制药往往有数十家生产厂家申报生产,形成“五代十国”的混战局面,严重挤压了仿制药的利润空间。
另一方面,重复性的仿制药申请量高居不下,也导致CDE对仿制及改剂型申请的审评等待时间不断的延长。2012年初,仿制及改剂型申请通道的审评等待时间为14个月;到2013年底,这一数字上升至34个月,严重影响了我国临床亟需仿制药的审评速度。
2012年11月,CFDA发布《仿制药质量一致性评价工作方案(征求意见稿)》。计划到2015年,完成基本药物目录中固体口服制剂质量一致性评价的工作任务,并于2015~2020年,开展注射剂及其他剂型的质量一致性评价工作。此举将促使仿制药企由价格竞争转向质量竞争。尽管目前仿制药一致性评价工作在参比制剂的选择和评价方法上遇到了一些问题,但这是中国由仿制药大国向仿制药强国迈进的必经之路。
观察
中国跑步进军欧美的机会来了
美国作为全球最大的仿制药市场,吸引着全世界仿制药厂商的目光。不断增加的仿制药申请文件积压在美国FDA的案头。为加速仿制药上市批准速度,美国FDA于2012年10月1日出台了新的《仿制药用户付费法案》(GDUFA),再次上调了包括ANDA申请费、药物批准费(PAS)、成品剂型设施费(FDF)在内的多项费用。尽管FDA希望通过此法案加快ANDA的评审速度,力图在5年后实现10个月内完成90%的ANDA申请的目标。但最终能获得何种收获,还值得商榷。
印度现已成为美国第二大药品进口国。有数据显示,目前印度出口到美国的仿制药金额约为930亿美元。但是最近,不断有印度药企被美国FDA警告甚至禁止产品进口的消息传出。2014年3月,美国FDA禁止从印度SunPharma位于古吉拉特邦的一家工厂进口药品。自去年年1月,美国FDA对印度的20家药厂提出了警告,其中两家属于RanbaxyLabs,两家属于Wockhardt。印度这三大仿制药巨头接连上榜美国FDA黑名单,影响了印度制药业的国际声誉,同时也在美国消费者心理留下了不小的阴影。
印度仿制药企在美国市场受挫,一方面提示我们优良的药物品质是进入美国市场的基础;另一方面,也给我中国仿制药企带来了进入美国市场的机会。近年来,中国仿制药企业中涌现出一批国际化先导企业,他们准备进入或已经涉足美国仿制药市场。据FDA统计,截至2012年,约有193家中国企业共提交了777份ANDA申请。
除美国医药市场以外,巨大的欧盟仿制药市场也为中国提供了丰富的机会。随着全球价值链的再造,欧盟部分仿制药产品已经完全依赖于中印两国的进口。2012年,中国作为欧盟第四大药品进口伙伴,位居美国、瑞士、新加坡之后,占欧盟药品进口额的4.2%。
欧美经济缓慢复苏,印度仿制药企频频受挫,全球医药价值链再造的齿轮再次滚动;中国制药工业正处于转型攻坚期,日渐微薄的原料药出口利润已无法满足我医药出口企业的胃口。天时地利人和,我国制药国际化企业踏入欧美仿制药市场更待何时! |
