自5月上旬开始,银杏叶药物相关的新闻占据着各大专业网站的头条,随即CFDA一系列关于专项治理以及关于银杏叶药物的补充检验方法等通知的出台使此事件暂时告一段落。然而一波未平一波又起,6月17日CFDA再次发出关于召回市售的小牛血去蛋白提取物注射液事件,一时间关于药物中间产品、生产工艺以及质量的监管成为了大家关注的焦点。人们不禁要问:为什么弄虚作假?怎么做到的?可以防范吗?米内网(研究员 lily-cha)自5月上旬开始,银杏叶药物相关的新闻占据着各大专业网站的头条,随即CFDA一系列关于专项治理以及关于银杏叶药物的补充检验方法等通知的出台使此事件暂时告一段落。然而一波未平一波又起,6月17日CFDA再次发出关于召回市售的小牛血去蛋白提取物注射液事件,一时间关于药物中间产品、生产工艺以及质量的监管成为了大家关注的焦点。人们不禁要问:为什么弄虚作假?怎么做到的?可以防范吗?
这真值得大家好好地思考一下了。因为企业生产的品种除有自检外,每年上市的药品都会遇到抽检,为什么没有发现问题,如果没有此次的飞行检查,这个问题能不能发现,都成为人们心中的疑问。下面我们仅以银杏叶事件为例做一个简单的剖析。
5月31日CFDA推出《关于进一步做好银杏叶药品专项治理的通知》,通知的第三条是关于强化银杏叶提取物的生产监管。通知规定用于药品生产的银杏叶提取物,其生产工艺和质量标准必须严格遵守2010版《中国药典》的规定;用于保健食品生产的银杏叶提取物,必须与保健食品注册申报的银杏叶提取物生产工艺和质量标准一致。由此我们看出,监管部门针对呈现工艺过程监控的质量标准的漏洞,迅速采取了补救措施解决问题,可谓快准狠。很显然这是一桩企业没有按正规工艺进行生产,而是按质量标准的限定值来改变工艺从而降低成本的事件。近年来随着中药材价格的大起大落,中药生产企业的成本控制风险日益加大,为更好地控制成本,一些大型制药企业如康美药业等早已开始自建药材生产基地。但是对于那些动辄几十味药材为处方的中药成方制剂,企业全部自建基地来满足生产显然非常不现实,于是从各大专业药材市场采购所需药材成为企业的家常便饭。
为保证产品质量,中国药典从源头的药材到中间体的提取物以及终产品的成品均制定了相关规定,其实这还只是入门标准,有些企业制定了更严格的企业标准。以银杏叶为例,2010年药典收载了银杏叶药材、银杏叶提取物、银杏叶片剂/胶囊/滴丸的标准,从标准的内容来看,银杏叶提取物的标准最为严格,它不仅包含了成品检验中的多数检验项目,还包括了重金属检验及总银杏酸的有关物质限量检查,但此次出问题的正是银杏叶提取物,这不得不说是个悲哀。6月4日CFDA又发布《银杏叶提取物、银杏叶片、银杏叶胶囊中游离槲皮素、山柰素、异鼠李素检查项补充检验方法》,这次发布的补充检验方法,是国家药品检验机构专门针对盐酸提取工艺和非法添加其他物质研究的新方法,只要是使用盐酸提取工艺和非法添加其他物质的,就可以直接检验出来。这还只是补充检验方法的一部分,其他的增项还在继续进行中。
从生产工艺来看,由于上市的成方制剂是在提取物的基础上,加入相关辅料制备而成,因此从检验项目的设定来说,提取物检验项目设定的严苛,在很大程度上可以保证成品的质量;但是进入市场后遭遇抽检的产品往往是成品,提取物不在抽检的范围内,因而对企业来说,只要能保证成品的相关检验符合药典标准,用低成本的提取物为原料就可以降低成品的成本,从而在激烈的市场竞争中占据有利位置。现在我们就把药典中关于银杏叶产品的质量标准中重要的检验项目做一个列表,看看我们应该关注那些项目。
表1 2010年药典银杏叶产品重点检验项目情况
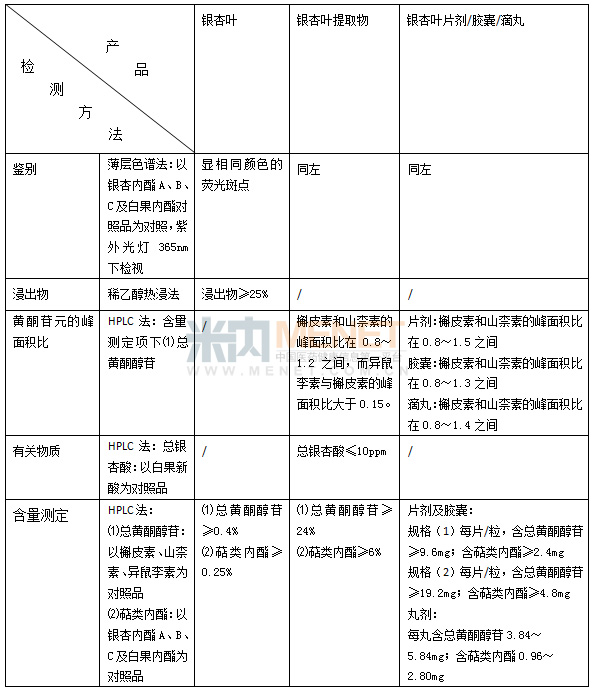
表2 美国欧盟银杏叶提取物药典标准部分检验项目
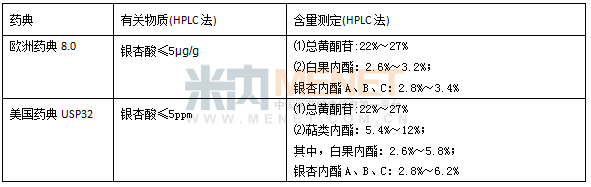
其实在2010年药典改版之际,康恩贝就因市场上银杏叶提取物的乱象,参与了提取物标准的修订工作。通过总结多年的试验数据以及参考美国和欧洲药典,最后确定了黄酮苷元的峰面积比值等相关项目,从而较好地控制了银杏叶产品质量。
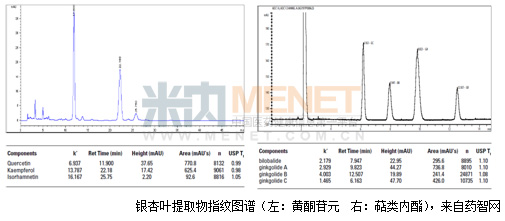
从上述表图可以发现,监管部门和有责任心的企业,为了中药的标准化已经做足了努力,但是由于国内银杏叶加工生产规模远未达到集约化程度,生产企业大多规模小、多而且分散,就算我国是世界公认的银杏故乡,而且银杏树保有量约占全球银杏树资源的90%,我们也还在产品的低端徘徊,并且由于恶性竞争,还导致作假事件频出。
此次事件还只是冰山一角,那些没有严苛标准的中药更加难以想象,我们常说中药走出去怎么走,只靠几家有良心有抱负的企业就行了吗。建立健全从药材种植到加工、提取及制剂生产等具有一定规模、能贯通整条产业链的优质企业,淘汰落后产能,给优质企业一个良好的市场环境成为当下迫切的事情。在监管方法,加强飞行经查与企业自检力度;在质量标准方法,逐步建立健全的指纹图谱(虽然因药材产地多样化及处方药味多等原因,建立起来不容易),才能减少类似事件发生,才能实现我们“中药走向世界”的宏愿。 |
