导读:近期,干细胞科学家们给公众分享了制造人视网膜---眼部中对光线敏感的部分---的配方。如今,在一项新的研究中,德国科学家们发现了另一种利用小鼠或人干细胞高效地制造三维视网膜类器官(retina organoids)的方法。他们制造的“微型视网膜(mini-retina)”为研究视网膜生长、损伤和修复提供新的视角。
近期,干细胞科学家们给公众分享了制造人视网膜---眼部中对光线敏感的部分---的配方。如今,在一项新的研究中,德国科学家们发现了另一种利用小鼠或人干细胞高效地制造三维视网膜类器官(retina organoids)的方法。他们制造的“微型视网膜(mini-retina)”为研究视网膜生长、损伤和修复提供新的视角。相关研究结果于2016年3月31日在线发表在Stem Cell Reports期刊上,论文标题为“Retinal organoids from pluripotent stem cells efficiently recapitulate retinogenesis”。
论文通信作者、德国神经退行性疾病中心(DZNE)研究员Mike Karl说,“我们的目标不只是制造最接近于真实视网膜的东西,而且也可能利用这种系统的灵活性开发出更多的方法研究视网膜组织。”
干细胞技术有潜力被用来开发出治疗诸如年龄相关性失明之类的疾病的方法,而且当临床研究人员努力利用干细胞开发新疗法时,诸如Karl之类的干细胞生物学家们一直在努力理解来自从低等脊椎动物到人类的神经元再生,从而有助以更加间接的方式促进再生医学研究。
比如,Karl实验室开发出的三维视网膜类器官高效地再现视网膜形成。这特别包括感光的视锥细胞,在Karl实验室制造出的这种微型视网膜中,这些视锥细胞能够大量地产生。在未来针对视网膜发生退化的病人开发的潜在细胞替换疗法中,负责高灵敏度和色觉的视锥细胞是最为珍贵的视网膜细胞类型。
Karl和同事们在体内比较了源自小鼠多能性干细胞的视网膜类器官、源自人多能性干细胞的视网膜类器官和小鼠视网膜,证实了这种新的视网膜类器官制造方法的可靠性。Karl说,“组织异质性是类器官系统中的一个主要挑战。这里,我们的研究提供新的认识,这将有助开发出基于类器官的特定模型,从而特别可靠地研究视网膜疾病机制。”
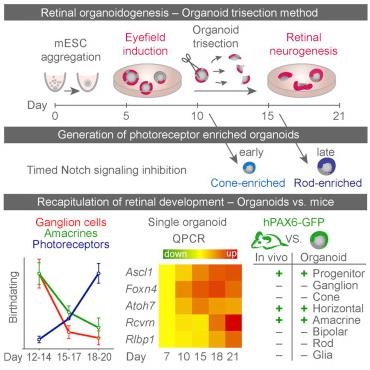
Karl实验室还对这种微型视网膜制造方法进行改变,涉及在眼部发育早期阶段将利用干细胞制造出的视网膜类器官切割成三个块。每块看起来类似于小半月,最终发育成在视网膜中发现的全套细胞,因而相比于之前的方法,视网膜类器官产生增加了高达4倍。这种三等分也促进存活下来的类器官块长大到类似于未切割时的类器官大小。这些微型视网膜在盘碟中自由游动,这是因为它们不再附着到盘碟表面上,从而更好地反映发育期间的视网膜组织结构。
Karl接下来的目标就是通过可能加入血管,让他的三维“微型视网膜”变得更加复杂, 以及利用这种类器官研究不同类型神经元(特别是来自人视网膜中)的再生和功能。(生物谷 Bioon.com)
Retinal Organoids from Pluripotent Stem Cells Efficiently Recapitulate Retinogenesis
doi:10.1016/j.stemcr.2016.03.001
Manuela Völkner, Marlen Zschätzsch, Maria Rostovskaya, Rupert W. Overall, Volker Busskamp, Konstantinos Anastassiadis, Mike O. Karl
The plasticity of pluripotent stem cells provides new possibilities for studying development, degeneration, and regeneration. Protocols for the differentiation of retinal organoids from embryonic stem cells have been developed, which either recapitulate complete eyecup morphogenesis or maximize photoreceptor genesis. Here, we have developed a protocol for the efficient generation of large, 3D-stratified retinal organoids that does not require evagination of optic-vesicle-like structures, which so far limited the organoid yield. Analysis of gene expression in individual organoids, cell birthdating, and interorganoid variation indicate efficient, reproducible, and temporally regulated retinogenesis. Comparative analysis of a transgenic reporter for PAX6, a master regulator of retinogenesis, shows expression in similar cell types in mouse in vivo, and in mouse and human retinal organoids. Early or late Notch signaling inhibition forces cell differentiation, generating organoids enriched with cone or rod photoreceptors, respectively, demonstrating the power of our improved organoid system for future research in stem cell biology and regenerative medicine. |
