角膜缘上皮干细胞缺乏可见于原发或获得性损害。部分或总体角膜缘上皮干细胞缺乏影响角膜伤口愈合和眼表完整性。缺乏可发生于外伤,包括化学伤和热烧伤、其他眼病诸如无虹膜、Stevens Johnson 综合征 (见图 7)。当角膜缘上皮干细胞缺乏造成结膜内生时,新生血管、慢性炎症、复发性上皮糜烂、溃疡和基质瘢痕都能造成疼痛性视力减退。视功能的长期维护需要角膜上皮的更新,通过自体或异体角膜缘移植更换干细胞能达此目的。自体角膜缘手术带来的风险包括损伤被取自体组织的健眼,异体移植者则必须接受免疫抑制剂治疗。作为一种更好的取代方法,培养的角膜上皮干细胞疗法正在兴起,角膜缘上皮干细胞在体外培养扩增,培养的方法有羊膜或纤维蛋白,通常培养基中辅以3T3成纤维饲细胞层。培养的自体粘膜上皮细胞植片也被用于角膜缘上皮干细胞缺乏眼表的重建获得某些成功。晚近,其他的干细胞族群包括人胚胎干细胞和毛囊干细胞(65)也能被分化衍生出角膜上皮样表型。这些激动人心的资料可能会导致未来对角膜缘上皮干细胞缺乏造成的盲人战略的变化。
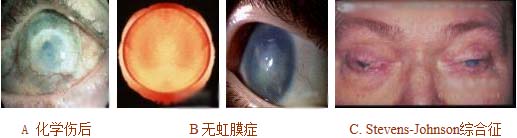
人眼化学伤(A)无虹膜(B)和Stevens-Johnson综合征因角膜缘干细胞总体衰竭造成的角膜新生血管和浑浊致盲。
临床上用培养的角膜缘干细胞移植获得成功确切的生物学机理还不清楚。衍生自骨髓的干细胞也能挽救角膜上皮干细胞缺乏造成的损害(66)。由于没有异体培养的角膜上皮干细胞长期存活标本,我们的假说是被移植的培养角膜缘上皮,至少在某些病人,可能通过受体受损的角膜上皮干细胞反冲式启动('kick-starting')作用修复角膜上皮。
儿童致盲的病因之一,先天性无虹膜,由于进行性眼表衰竭造成角膜浑浊。大多数病人源于PAX6单倍体不足造成的杂合子无效突变。患者双侧全眼球罹患病变,最突出的是虹膜发育不全,表现为虹膜变异到完全缺如,常常伴发白内障、角膜血管化和青光眼,有相当一部分病人,因为角膜异常出现视力障碍。对这种异常的根本原因所知甚少,一般认为系干细胞衰竭所致。然而,有人认为是干细胞龛的缺乏和邻近角膜水肿所致(68)。晚近,认为Pax6下调牵涉到异常的角膜上皮细胞分化。治疗常常累及用角膜缘异体移植或培养的角膜缘上皮干细胞移植来取代病变组织。
无虹膜表现为从虹膜缺失到轻度基质发育不全而瞳孔外观正常等虹膜解剖缺损一连串病变。其他相关的缺损包括中心凹发育异常、视神经发育异常、眼球震颤、青光眼和白内障。这些情况可能随着年龄增长引发进行性视力障碍。其他导致视力进行性下降的重要因素是与无虹膜相关联的角膜病变。患者中有90%有角膜病变,而这些人在少儿时期角膜看起来正常(70)。10岁过后随着病变发展出现增厚的不规则角膜周边上皮,接着发生浅层血管翳,如果不予治疗,就会造成上皮下纤维化和基质瘢痕。而且,患者还会常常发生复发性上皮糜烂、角膜溃疡、慢性疼痛而最终致盲。组织学上有角膜基质血管新生和炎症细胞浸润和前弹力膜破坏。此外,角膜表面可见结膜杯状细胞。这些临床和组织学表现与无虹膜患者角膜缘上皮干细胞缺乏所造成的角膜病变相一致。
基于无虹膜的临床和组织学表现,学者们已经推测到,角膜上皮干细胞缺乏是无虹膜患者的病理成因。作为一种角膜缘上皮干细胞标记物,迄今为止作出的定义性认定,不能把角膜上皮干细胞缺乏作为一种假设。况且,对这些病人的治疗涉及角膜缘上皮干细胞的置换,通过角膜角膜缘异体移植或培养的角膜上皮干细胞移植均能获得比常规角膜移植更好的结果。因而可以认为角膜上皮干细胞缺乏是肯定的事实。然而,如果病人同时接受角膜缘和角膜两者,则会获得更加满意的结果,提示无虹膜患者不仅仅是角膜缘异常,角膜本身也有异常。这可能是角膜上皮干细胞缺乏下游的作用。低水平的PAX6可能对全角膜有一种广泛的影响。无虹膜也能是异常角膜上皮/基质愈合应答的一种结果,因为单是角膜上皮干细胞增殖潜力异常还不足以提供证据。晚近的研究,正在寻找Pax6杂合子鼠Pax6基因调节的下游,提示无虹膜的病理成因是由于许多机制,而非单单只有角膜上皮干细胞缺乏。进一步研究,阐明无虹膜精确的病理机制,对于应用更完善的治疗措施是必要的。
Pax6 的突变造成一种明显小眼综合征(SEY)鼠和大鼠。这些动物是研究无虹膜症和有关进展性角膜异常病变的出色实验模型。这个命名提示,半显性的突变鼠发生小眼和其他眼部异常。半显性杂合子表型SEY鼠表现出相对发育的眼部异常,其中包括小眼球和虹膜、晶体和网膜缺损,具有多种表型严重异常。白内障、青光眼和更重要的角膜异常,会在产后发育中乃至成年才发展为突变SEY。极有意义的是,表型变异在单个SEY株的不同鼠中能够看到,甚至可在同一鼠的两只眼中发现。通过检查比较性基因图谱研究和无虹膜二者表型的相似和不同之处,提示人类的无虹膜疾病与鼠同源。这项研究导致Pax6基因的发现,是造成Sey表型的原因,也是造成人类无虹膜的原因。这些模型正在帮助我们致力于搞清关于角膜缘上皮干细胞的基本疑问及其龛环境的细节。
参考文献
1)Nakamura M, Endo K.-I, Cooper L.J, et al. The successful culture and autologous transplantation of rabbit oral mucosal epithelial cells on amniotic membrane. Invest Ophthalmol Vis Sci. 2003;44:106–116.
2)Ahmad S, Stewart R, Yung S, et al. Differentiation of human embryonic stem cells into corneal epithelial like cells by in vitro replication of the corneal epithelial stem cell niche. Stem Cells. 2007;25:1145–1155.
3)Blazejekska E.A, Schlotzer-Schrehardt U, Zenkel M,et al. Corneal limbal microenvironment can induce transdifferentiation of hair follicle stem cells into corneal-like epithelial cells.Stem Cells 2009,27:642-52.
4)Daya S.M, Watson A, Sharpe J.R, et al. Outcomes and DNA analysis of ex vivo expanded stem cell allograft for ocular surface reconstruction. Ophthalmology. 2005;112:470–477.
5)Van Heyningen V, Williamson K.A. PAX6 in sensory development. Hum Mol Genet. 2002;11:1161–1167.
6)Ramaesh K, Ramaesh T, Dutton G.N,et al. Evolving concepts on the pathogenic mechanisms of aniridia related keratopathy. Int J Biochem Cell Biol. 2005;37:547–557.
7)Li W, Chen Y.-T, Hayashida Y, et al. Down-regulation of Pax6 is associated with abnormal differentiation of corneal epithelial surface diseases. J Pathol. 2008;214:114–122.
8)Nishida K, Kinoshita S, Ohashi Y,et al. Ocular surface abnormalities in aniridia. Am J Ophthalmol. 1 995;120:368–375.
9)Dua H.S, Azuara-Blanco A. Limbal stem cells of the corneal epithelium. Surv Ophthalmol. 2000;44:415–425.
10)Shortt A.J, Secker G.A, Notara M.D,et al. Transplantation of ex-vivo cultured limbal epithelial stem cells–a review of current techniques and clinical results. Surv Ophthalmol. 2007b;52:483–502.
11)Ramaesh K, Ramaesh T, Dutton G.N,et al. Evolving concepts on the pathogenic mechanisms of aniridia related keratopathy. Int J Biochem Cell Biol. 2005;37:547–557.
12)Matsuo T, Osumi-Yamashita N, Noji S, et al. A mutation in the Pax-6 gene in rat small eye is associated with impaired migration of midbrain crest cells. Nat Genet. 1993;3:299–304.
13)Callearts P, Halder G, Gehring W.J. PAX-6 in development and evolution. Annu, Rev Neurosci. 1997;20:583–532.
14)Lyon M.F, Bogani D, Boyd Y,et al. Further genetic analysis of two autosomal dominant mouse eye defects, Ccw and Pax6(coop). Mol Vis. 2000;6:199–203
15)Van Ramsdonk C.D, Tilghman S.M. Dosage requiremenr and allelic expression of PAX6 during lens placode formation. Development. 2000;127:5439–5448.
16)Glaser T, Lane J, Housman D.A mouse model of the aniridia-Wilms tumor deletion syndrome.Science. 1990 , 250:823-827.
17)Hill R.E, Favor J, Hogan B.L, et al. Mouse small eye results from mutations in a paired-like homeobox-containing gene. Nature. 1991;354:522–525. |
