|
结果
一、CNV生长动态检测
CDI治疗Ⅰ组:术后第5天,10只眼出现新生血管芽,4只眼有较明显新生血管开始伸入,4只眼仅有血管轻度扩张;第10天,15只眼出现生长极缓慢的新生血管,管径细,角膜透明。
CDI治疗Ⅱ组:术后第5天,14只眼可见新生血管自角巩缘向植入物伸入生长;第10天,18只眼均有明显新生血管生长,最长者约2.3 mm。此2组生长速度与15%内毒素组比较,差异有非常显著性(P<0.001)。
15%内毒素组:术后第3天可见新生血管开始向角膜内延伸,第9天集中朝向植入物生长的新生血管已达药丸周围并逐渐成包围状。
空白对照组:未见具有统计意义的新生血管生长(图3~5)。
|
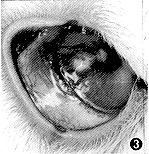
图3 15%内毒素组诱导兔CNV生长第12天,可见明显的新生血管生长,集中朝向药丸方向并呈包围状 |
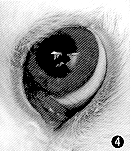
图4 CDI治疗I组抑制兔CNV生长第12天,无新生血管增生,角膜透明 |
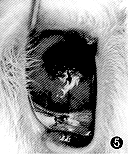
图5 CDI治疗Ⅱ组抑制兔CNV第12天,可见少量新生血管增生,血管较细,生长缓慢 |
二、CNV染色标本定量分析
第16天各组CNV生长面积平均值比较,CDIⅠ组和CDIⅡ组与15%内毒素组比较差异均有显著性(P<0.001),对新生血管抑制率分别为87.8%和59.3%(表1)。
表1 CDI对各组兔CNV生长抑制情况的比较
| 组别 |
眼数 |
生长速度
( ±s,mm/d) ±s,mm/d) |
生长面积
( ±s,mm2) ±s,mm2) |
抑制率
(%) |
| CDI治疗Ⅰ组 |
18 |
0.045±0.036* |
2.212±0.648* |
87.8 |
| CDI治疗Ⅱ组 |
17 |
0.150±0.029* |
7.357±0.652* |
59.3 |
| 15%内毒素组 |
17 |
0.26 ±0.08 |
17.07 ±1.50 |
0.0 |
*与15%内毒素组比较,P<0.01
三、光镜下病理检查
CDI治疗Ⅰ组:角膜基质炎性改变较轻,可见散在炎性细胞,新生血管少见且远离植入物表面,生长缓慢。
CDI治疗Ⅱ组:基质内有较明显的新生血管长入,新生血管管径均较细。
15%内毒素组:角膜基质内可见许多新生血管自角巩缘伸至内毒素植入物附近,新生血管管径粗细不等,微袋周围可见大量的炎性细胞浸润(图6~8)。
|
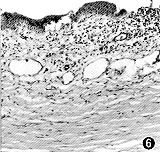
图6 15%内毒素组第12天可见兔CNV角膜组织中有较多炎性细胞聚集,新生血管在层间增生,较粗大,基地膜完整 HE×115 |
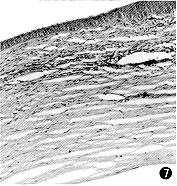
图7 CDI治疗Ⅰ组第12天,角膜组织中有炎性细胞浸润,无明显新生血管增生 HE×115 |
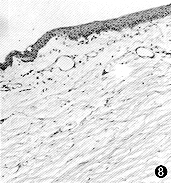
图8 CDI治疗Ⅱ组第12天,角膜组织内有少量管径较细的新生血管在层间增生,亦有炎性细胞聚集 HE×115 |
讨论
一、CDI抑制新生血管生长的机制与作用
近年来的实验研究发现,软骨组织内无血管存在,并且极少有肿瘤侵害的现象,其原因与软骨组织中存在一种相对分子质量为27 000的低分子蛋白质,即与软骨源抑制因子(CDI)密切相关。新生血管的发生有其复杂的机制,已经清楚的是毛细血管内皮细胞对基底膜的穿透,在基质内毛细血管内皮细胞向刺激源移行和增殖是完成血管合成的关键步骤[4]。Moses等[5]首先在以碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)作刺激源的EC培养中观察到CDI能特异性地抑制EC的增殖和移行,并认为可能是抑制EC的DNA合成。CDI在鸡胚尿囊膜(chick chorioallantoic membrane,CAM)分析中其对血管合成的抑制率达87%[6]。本结果表明,纯化的CDI在活体组织中也能抑制由内毒素诱导的CNV生长,对兔CNV的生长速度和面积均有显著的抑制作用(P<0.001)。而其抑制率随CDI剂量的增加而提高,呈剂量依赖性。当缓释药丸中CDI剂量为每丸400 μg时,其抑制率为87.8%。
在试管内,仅4 μg CDI就能在CAM分析中产生明显的无血管区[5]。而我们直接用于兔CNV模型时剂量为每丸400 μg,目的是为了维持每天一定的释放量并在缓释药丸中维持一定比例的浓度。Langer等[7]曾精确测定Elvax制成的缓释丸释放量,当缓释丸中含有一定浓度以上的生物大分子物质时,其每天释放量达100~500 μg,可连续释放20~40天。本结果示,连续释放CDI在2 mm距离内对由内毒素诱导的CNV抑制效果可靠。
二、CDI抑制新生血管生长的病理基础
病理改变表明,CDI治疗Ⅰ组角膜基质内可见炎性细胞浸润,说明内毒素诱发的炎症反应同样存在,但未见明显的新生血管增生。以往的CNV研究认为,炎症介质诱导时炎性细胞等可释放出大量血管生成因子如肿瘤坏死因子和白细胞介素-2等[8],从而导致新生血管生长。我们认为,本实验中各种血管生成因子未发挥作用,恰是CDI直接干扰了EC的增殖和移行的结果。表现为有一定的角膜炎症反应而无明确的新生血管生长效应。在未来的新生血管治疗中,CDI的这种性质可能具有十分重要的意义。
参考文献
[1] Folkman J,Ingber D.Inhibition of angiogenesis. Semin Cancer Biol, 1992,3:89-96.
[2] 高晓唯,刘玉清,楼月芳,等.内毒素诱导法制作兔角膜新生血管 模型的实验研究. 中国实用眼科杂志,1996,14:720-722.
[3] D′Amato RJ, Loughnan M S,Flynn E, et al.Thalidomide is an inhibitor of angiogenesis.Proc Natl Acad Sci USA,1994,91:4082-4085.
[4] Klagsbrun M, D′Amore PA. Regulators of angiogenesis. Annu Rev Physiol,1991,53:217-239.
[5] Moses MA, Sudhalter J,Langer R.Identification of an inhibitor of neovascularization from cartilage.Science,1990,248:1408-1410.
[6] Moses MA, Sudhalter J, Langer R. Isolation and characterization of an inhibitor of neovascularization from scapular chondrocytes.J Cell Biol,1992,119:475-482.
[7] Langer R,Folkman J.Polymers for the sustained release of proteins and other macromolecules. Nature,1976,263:797-800.
[8] Leibovich SJ,Polverini PJ,Shepard HM,et al.Macrophage-induced angiogenesis is mediated by tumour necrosis factor-alpha. Nature,1987,329:630-632.
(收稿:1998-03-31 修回:1998-08-24)) 上一页 [1] [2] |
