脂肪干细胞(adipose-derived stem cells,ADSCs)是存在于脂肪组织的间充质干细胞,具有多向分化潜能,在特定的条件下可以分化为脂肪细胞、成骨细胞、成软骨细胞等中胚层细胞,甚至可以跨胚层分化为神经细胞等外胚层细胞及肝细胞等内胚层细胞。ADSCs还有易于获取、对取材区损伤小等众多优势,使其成为组织修复等领域的热点之一。

本文对ADSCs的生物学特性及其在眼科领域的研究进行了分类总结,以期为ADSCs在眼科的应用研究给予有益的提示。
脂肪干细胞(adipose-derived stem cells,ADSCs)是来源于脂肪组织,具有多向分化潜能的间充质干细胞。作为成体干细胞重要组成的ADSCs,因其不存在伦理学问题、易于获取、体外增殖迅速及低免疫原性等众多优势,引起大家广泛关注。
在眼科领域,ADSCs相关的研究取得了长足进展。我们就ADSCs的生物学特性及其在眼科领域的研究成果、研究中存在的问题及应用前景做一归纳总结,以期对今后的相关研究提供一些借鉴和思路。
1.ADSCs概述
1.1 ADSCs的来源
2001年,Zuk等首次于抽脂术后脂肪组织废弃液中分离出的脂肪血管基质成分中获取了脂肪组织来源干细胞。其中,脂肪血管基质成分是ADSCs、内皮细胞、平滑肌细胞、周细胞、成纤维细胞、淋巴细胞及脂肪前体细胞等组成的细胞混合物。
ADSCs的获取简单、方便,可以从人脂肪抽吸术所得脂肪组织中大量获得,约400~600mg脂肪组织即可获得5×105个干细胞。
1.2 ADSCs的鉴定及多向分化潜能
研究发现,ADSCs不仅与骨髓间充质干细胞在形态上比较相似,而且均表达间充质干细胞的表面标志物CD73,CD90和CD29,而不表达造血及内皮细胞表面标志物CD31,CD34,CD45和CD14。但是两者之间也存在一定差异,如CD106在ADSCs中不表达而在骨髓间充质干细胞中阳性表达;CD49d在ADSCs中表达而不在骨髓间充质干细胞表达。
目前,大多数文献仍以成脂、成骨等多向分化能力的鉴定作为ADSCs鉴定的主要方法。
近年来,随着ADSCs诱导分化方面研究的深入,已经证实ADSCs不仅能够分化为中胚层细胞如脂肪细胞、成骨细胞、心肌细胞等,而且可跨胚层分化为外胚层细胞如神经细胞等、内胚层细胞如肝细胞等(图1)。
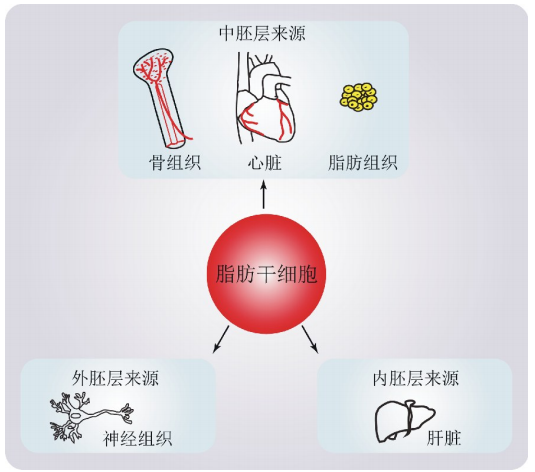
图1ADSCs多向分化潜能。
2.ADSCs在角膜上皮的应用研究
角膜上皮来源于角膜缘干细胞的定向分化,具有较强的再生能力。但当角膜严重损伤后引起大范围角膜周围纤维细胞浸润、角膜翳及角膜瘢痕形成等,最终将导致角膜缘干细胞缺失(limbal stem cell deficiency,LSCD)。
角膜移植是LSCD较好的治疗方法,但因为供体不足、术后植片衰竭及免疫排斥反应严重限制了这种治疗。干细胞移植不失为一个替代方法。
ADSCs在角膜上皮的应用可以分为两类。一类是ADSCs对受损角膜上皮愈合的应用研究;另一类是ADSCs向角膜上皮细胞分化的研究。
2.1 ADSCs
对受损角膜上皮愈合影响的应用研究研究表明,ADSCs具有促进角膜上皮愈合,降低免疫反应的作用。Agorogiannis等报道了一例以自体ADSCs治疗持续性角膜上皮缺损的患者。患者因橄榄树叶造成角膜上皮创伤,形成溃疡,迁延不愈。对患者进行自体ADSCs移植,术后11d角膜上皮开始愈合,术后1mo,患者角膜上皮完全愈合。术后6mo随访,角膜上皮保持完整。
Zeppieri等以角膜碱化学伤的大鼠作为实验动物,局部进行人ADSCs的移植。组织学结果显示局部进行ADSCs移植后,受损动物角膜完全愈合,与对照组相比免疫细胞较少。说明ADSCs促进受损角膜上皮愈合。
Lin等将ADSCs悬液采用兔结膜下注射的方法治疗实验兔眼表碱化学伤,研究发现实验组角膜愈合的速度比对照组更快,组织学检测显示实验组形成了5~6层角膜上皮细胞层,而对照组为2~3层角膜上皮细胞层。
以上研究提示ADSCs移植于受损的角膜上皮,可以促进角膜上皮的再生和修复,加速角膜的愈合。然而,ADSCs在促进受损角膜上皮愈合的同时,是否其本身也有分化的倾向,以及最终的转归如何等问题值得进一步探讨。
2.2 ADSCs向角膜上皮细胞分化的研究
近年,ADSCs向角膜上皮细胞分化的潜能得到了证实。钟刘学颖等在体外探究了不同的诱导体系对人ADSCs的分化作用。诱导体系中主要包括DMEM/F12体系、KM体系以及前两者1:1的混合体系DMEM/F12/KM体系,并添加不同浓度的表皮生长因子(epidermal growth factor,EGF)。
结果显示,不同浓度梯度细胞生长因子的KM体系诱导21d,广谱角蛋白AE5阳性细胞约占90%以上,其中40g/L、50g/LEGF组AE5阳性表达率达到98%以上。
Martinez-Conesa等将ADSCs培养于细胞外基质层,免疫荧光结果显示细胞角膜上皮角蛋白CK3/76阳性表达,PCR结果显示细胞表达了祖细胞表面标志物p63及ABCG2,角膜上皮标志物CK12阳性表达。Western结果显示诱导后ADSCsp63阴性、CK3/76和CK12弱阳性。
Ho等分别研究了眼眶脂肪组织来源和皮下脂肪组织来源的ADSCs诱导分化为角膜上皮样细胞的能力。实验分为3组:第1组,角膜上皮细胞和ADSCs混合培养;第2组,角膜上皮细胞来源的条件培养基培养ADSCs;第3组,角膜上皮细胞和ADSCsTranswell共培养。
5d后荧光染色眶脂来源的ADSCs第1组混合培养的ADSCsCK3阳性表达,第2组、第3组未观察到阳性结果。皮下脂肪来源的ADSCs仅在第1组有少量表达。
Nieto-Miguel等研究了皮下脂肪组织诱导分化为角膜上皮样细胞的能力。实验分为基础培养液组(basal culture medium,BM)、角膜上皮细胞来源条件培养液(BM conditioned with human corneal epithelial cells,HCEcBM)、角膜缘成纤维细胞来源条件培养液组(BM conditioned with limbal fibroblasts,LFcBM),各组分别培养于普通培养皿、Ⅳ型胶原包被的培养皿中。
诱导第15d,光镜下观察到HCEcBM组细胞发生了上皮样改变。诱导第1,8,15,22d,RT-PCT结果显示HCEcBM组细胞CK12明显增高,这一结果被Westernblotting结果证实。
诱导后15d免疫荧光检测显示,HCEcBM组、LFcBM组细胞核周区域CK12阳性表达。另外,实验结果表明普通培养皿、Ⅳ型胶原包被的培养皿对于诱导细胞分化方面没有显著的统计学意义。
这些结果提示ADSCs可诱导为角膜上皮样细胞,具有分化为角膜上皮细胞的潜能,但细胞在体条件下是否能保持角膜上皮细胞表型、细胞分化过程中细胞是否有其他表型等问题,需要进一步实验证实。
3.ADSCs在角膜基质的应用研究
角膜基质层约占角膜厚度的9/10,由胶原纤维、角膜细胞等组成。其中,胶原纤维的有序排列是角膜透明的基础,也使角膜具有了一定的弹性和韧性。角膜基质损伤后不能再生,通过瘢痕修复损伤部位,影响角膜的透明性。
ADSCs可以减低损伤部位的免疫反应,并且成功修复角膜基质,形成板层结构。Arnalich-Montiel等将人ADSCs直接注入活体兔角膜内,术后12wk仍可检测到人ADSCs的存在,没有免疫排斥的现象发生,并且免疫学检测显示,细胞表达角膜基质细胞特异性蛋白聚糖keratocan,提示在体内微环境诱导下人ADSCs向角膜基质细胞方向分化。
鲍慧婧等将自体兔ADSCs与聚乳酸-聚羟基乙酸共聚物(polylactic-co-glycolic acid,PLGA)支架复合后移植于兔角膜基质,成功重建受损的兔角膜基质。
研究显示兔ADSCs在PLGA支架上生长良好,材料12wk以后降解,角膜基本恢复透明。HE染色显示新生角膜基质与正常组织相似,电镜下可见原缺损部位胶原纤维直径与正常组织无统计学差异。
Du等采用不同的诱导液在体外诱导人ADSCs向角膜基质方向分化。实验因培养方法不同,分为纤维蛋白凝胶组和微球法培养组,角膜基质诱导液培养3wk。免疫学检测显示keratocan及硫酸软骨素在两组不同方法培养的细胞的表达,其中微球法培养组比纤维蛋白凝胶组表达广泛。
Keratocan的表达通过RT-PCR方法得到证实。研究结果提示两种方法均诱导人ADSCs分化为角膜基质细胞样的细胞。
Espandar等将人ADSCs接种于透明质酸类支架,以细胞质内膜荧光蛋白分子为标记,移植于兔角膜基质层。术后10wk检测发现,人ADSCs不仅在基质层生长良好,而且表达了角膜基质细胞特异性蛋白keratocan、醛脱氢酶、玉型胶原等。
虽然上述研究表明ADSCs向角膜基质样细胞分化,提示了ADSCs的分化潜能。但是,ADSCs分化后,是否有部分细胞仍具有干细胞特性,是否可以不断分化为角膜基质细胞等问题需要进一步的相关实验予以探究。
4.ADSCs在视网膜的应用研究
视网膜由内层的神经上皮及外层的视网膜色素上皮构成,具有感光并对光刺激进行处理的重要功能。
许多视网膜疾病严重损害视力甚至致盲,如视网膜遗传性、变形性病变,而目前的治疗方法不能阻止其进展。干细胞在视网膜疾病的相关研究为视网膜疾病治疗提供了一个新的探索方向。
ADSCs在添加合适的诱导液后,可以分化为视网膜光感受器细胞、色素上皮细胞及神经胶质细胞等。
许卓再等以不同的诱导方案尝试将大鼠ADSCs诱导分化为视网膜光感受器细胞及视网膜色素上皮细胞。实验主要分为对照组、单独诱导组、联合诱导组。
主要诱导剂为EGF、激活素A、牛磺酸、视黄酸、视网膜细胞提取液等。各诱导组在诱导28d后细胞均在一定程度上表达了视紫红质、上皮细胞骨架蛋白CK及神经嵴细胞来源S-100蛋白。
其中,单独诱导组各组间诱导效应相似,而联合诱导组中包含EGF、牛磺酸、视黄酸的诱导组效应较好。提示ADSCs具有向光感受器及视网膜上皮细胞分化的潜能。
2009年Vossmerbaeumer等采用人或猪的视网膜上皮细胞来源条件培养基诱导人ADSCs向视网膜色素上皮(retinalpigmentepithelium,RPE)方向分化。诱导液主要包括RPE来源的条件培养液、血管活性肠肽等,以不同的组合构成相应分组。
诱导5~8d后,结果显示ADSCs表达了视网膜色素上皮细胞特异性蛋白Bestrophin,CK8,CK18及RPE65。促黑素细胞激素(melanocyte-stimulating hormone,MSH)诱导分化的ADSCs色素颗粒的形成。
晁炜静等体外诱导人ADSCs向视网膜细胞分化,免疫荧光显示诱导后细胞表达视紫红质和Pan-CK,提示细胞向光感受器细胞和视网膜色素上皮细胞分化。
2010年,Yang等采用糖尿病大鼠作为动物模型,探讨ADSCs移植对于糖尿病视网膜病变的改善。
ADSCs移植术后1wk,血糖水平显著降低。伊文思蓝染色基本没有渗漏,提示血视网膜屏障的完整性提高。术后可以观察到ADSCs存在于大鼠视网膜,并且表达了光感受器特异性蛋白视紫红质和星形胶质细胞特异性蛋白胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)。
韩国学者Yu等将人ADSCs移植于C57/BL6小鼠,以GFP作为示踪蛋白探究ADSCs在发育阶段鼠眼中的分化及转归。实验根据小鼠出生不同天数、移植后存活天数分组。
结果发现,部分ADSCs表达了成熟神经元的标志物微管相关蛋白质(microtubule-associated protein2,MAP-2)、神经胶质细胞标志物GFAP。出生后第5,10d,移植后7d被处死的小鼠比其他组分化的较好。然而,与其他干细胞如脑前体细胞相比,ADSCs向视网膜方向的分化非常有限。
ADSCs向视网膜神经及色素上皮细胞的分化研究中,细胞虽然表达了光感受器细胞的标志物,但是仍存在细胞是否具有正常光感受器细胞的功能以及分化细胞占ADSCs的比例等问题。
5.展望
ADSCs的发现,极大地丰富了干细胞库,并且在眼科领域的深入探索为Stevens-Johnson综合征、严重的细菌感染及化学烧灼伤所致角膜缘干细胞缺失、视网膜遗传性、变性性疾病等难治性眼病提供了一个可能的选择。
目前,已经有关于ADSCs向角膜上皮细胞、角膜基质细胞及视网膜神经、色素上皮细胞分化及应用研究的报道。然而,这些研究仍存在许多问题:
(1)ADSCs的纯化问题。
(2)绝大部分研究为动物实验。在动物实验得到的结果,是否在人体也能得到相似的结果。
(3)ADSCs在眼科的应用研究还停留在细胞表型的分化研究。对于ADSCs分化为某种成熟细胞表型后是否具备相应的功能。
(4)分化过程中的哪些通路和因子起到关键作用。
(5)ADSCs在眼科领域的诱导分化尚未有成熟的诱导方案。
综上所述,ADSCs在体外或体内条件下具有促进角膜损伤愈合、向角膜上皮细胞、基质细胞、视网膜神经细胞、视网膜色素细胞分化的可能,有望成为眼科难治性疾病治疗的新途径。 |
