|
结果
1.细胞培养:组织块接种后细胞很快呈膜状扩展生长,约10天达生长饱和,细胞大小一致,呈多角形,角膜缘和角膜中央上皮细胞的形态相同,仅后者细胞略大(图1,2)。不同的是角膜中央上皮细胞在传第1代后细胞基本停止生长,细胞从多角形变为长梭形,不能形成细胞单层(图3);而角膜缘上皮细胞能够保持增殖至第3~5代后才逐渐丧失上皮细胞形态,生长停止(图4)。
|

图1 角膜缘上皮细胞原代培养第10天 ×100

图3 角膜缘上皮细胞传第3代培养第7天 ×200 |
图2 角膜中央上皮细胞原代培养第10天 ×100
图4 角膜中央上皮细胞传第1代第10天 ×100 |
2.干细胞的增殖能力:统计分析显示,EGF和细胞类型对CFE的影响差异有显著性(F=60.55,P<0.01)(表1)。
表1 不同质量浓度EGF对兔角膜上皮细胞
CFE的影响(n=18)
| EGF
质量浓度
(ng/ml) |
角膜缘
干细胞
( ±s,%) ±s,%) |
角膜中央
上皮细胞
( ±s,%) ±s,%) |
t值 |
| 对照 |
5.07±2.35 |
3.12±1.06 |
-7.83 |
| 5 |
6.03±2.14 |
3.74±1.18 |
-9.75 |
| 20 |
6.11±1.83 |
4.42±1.38 |
-7.66 |
| 100 |
4.76±1.36 |
2.99±1.10 |
-10.49 |
注:对照组与不同质量浓度EGF各组间及角膜缘干细胞与角膜中央上皮细胞间比较,P<0.01 本结果为不同时间CFE的平均数。角膜中央上皮细胞在接种后1周内CFE达到高峰(图5),随后逐渐下降,而角膜缘干细胞的CFE逐渐升高,至接种后10~12天达到高峰,两者比较角膜缘干细胞的增殖潜力明显高于角膜中央上皮细胞;而不同质量浓度的EGF对角膜上皮细胞增殖均有影响,以5和20 ng/ml质量浓度对促进干细胞增殖作用显著(t=4.02,P<0.01),100 ng/ml质量浓度作用8天后抑制细胞增殖(t=4.14,P<0.01)。
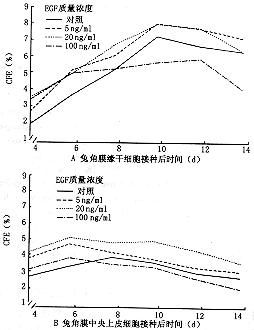
图5 兔角膜上皮细胞增殖曲线及EGF的影响
3.细胞冻存复苏率:按常规细胞冻存复苏方法,细胞复苏后CFE分别为角膜中央上皮细胞的(0.16±0.07)%、角膜缘细胞的(0.43±0.22)%,两者比差异有显著性(t=5.54,P<0.01)。
4.角质蛋白K3表达:在正常兔角膜组织切片的免疫组化染色中,角膜缘基底层细胞角质蛋白K3不表达,表现为细胞染色呈绿色,而表浅细胞则为阳性呈棕黑色,并且越向角膜中央上皮细胞层角质蛋白K3表达越多,在中央上皮基底细胞也可见角质蛋白K3表达(图6~9)。盖玻片上生长的角膜缘上皮细胞在原代培养基本不表达角质蛋白K3(图10),在传2代细胞时大部分表达角质蛋白K3呈棕黑色(图11,12)。而角膜中央上皮细胞在早期即表达K3。
通过蛋白质免疫印迹检测分析发现,角膜缘干细胞在原代和第2代时能够检测到角质蛋白K3的表达,至第4代时角质蛋白K3为阴性,而角膜中央上皮细胞在原代和传第1代均表达K3, 并且传第1代 细胞表达更明显(图13)
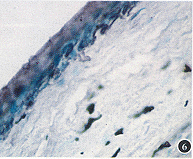
图6 正常兔角膜上皮表达角质蛋白K3的兔疫组化染色,示角膜缘 ×100

图7 示图6角膜周边
图8 示图6角膜中周区

图9 示图6角膜中央

图10 角膜缘干细胞原代培养AE5染色阴性 ×100

图11 角膜缘干细胞第2代AE5染色阳性 A×100,B×400

图12 角膜中央上皮细胞AE5染色阳性 A原代×100,B传第1代早期×100

M示标准蛋白 1示角膜缘干细胞原代培养 2示干细胞传第2代培养
3示干细胞传第4代培养 4示角膜中央上皮细胞原代培养 5示角膜中央传第1代培养 6示角膜基质细胞传第1代培养 7示正常兔角膜上皮细胞(阳性对照) 8示PBS(阴性对照)
图13 兔角膜上皮细胞表达角质蛋白K3的蛋白质印迹
讨论 1.干细胞的增殖能力:1986年Schermer等[5]检测确定角膜缘基底细胞中部分细胞是唯一不表达角质蛋白K3的角膜上皮细胞,从而证实角膜干细胞位于角膜缘基底部。我们采用造血干细胞的脾CFE测定细胞增殖率显示,角膜缘干细胞在培养早期CFE较低,随着对培养环境的适应其增殖潜力逐渐发挥出来,明显较中央上皮细胞高,与Ebato等[7]的研究结果类似。细胞冻存复苏后测定的角膜上皮细胞CFE显示,角膜缘干细胞明显高于角膜中央上皮细胞。然而,由于细胞冻存复苏率普遍偏低,因此有待进一步研究新的细胞保存方法以满足实验的需要。
在EGF的作用下,角膜缘干细胞的增殖能力提高超过角膜中央上皮细胞,尤其是在质量浓度为5~20 ng/ml时作用明显,而在质量浓度为100 ng/ml时作用则相对下降,说明该EGF在体外对角膜上皮细胞的促增殖作用有量效关系[8]。
2.干细胞的分化特点:正常角膜上皮组织中角膜缘基底细胞不表达角质蛋白K3是角膜缘干细胞的特性之一,与本研究结果一致。并且原代培养的角膜缘干细胞不表达角质蛋白K3,是因为角膜上皮细胞在培养条件下丧失了表达角质蛋白K3的能力,随着对培养环境的适应细胞逐渐分化表达[9],保持着角膜上皮细胞的特征,而角膜缘基底细胞具有进一步增殖分化的潜力,可以完成向角膜上皮细胞转化的过程[7],角膜中央上皮细胞已经处于细胞分化的高级阶段,所以在原代培养时可以部分表达K3。然而,蛋白质免疫印迹显示,角膜缘干细胞在培养早期即有角质蛋白K3的表达,可能一方面是该检测方法敏感性高,少量角质蛋白K3即能测出;另一方面因为培养的角膜缘细胞中干细胞仅为其中的一小部分,主要仍然是角膜上皮细胞,加之该方法是对大量细胞混合物的检测,所以细胞表现为阳性结果。
本研究表明,离体培养的角膜缘干细胞在培养的初期(第1、2代)与体内角膜干细胞具有相同的特征,即增殖能力高、具有干细胞固有的分化特征,适合于进行角膜干细胞移植治疗角膜缘功能衰竭症,以及作为药物筛选的细胞模型。
参考文献
[1] Cotsarelis G, Cheng SZ, Dong G, et al. Existence of slow-cycling limbal epithelial basal cells that can be preferentially stimulated to proliferate: implications on epithelial stem cells. Cell, 1989, 57:201-209.
[2] Kruse FE. Stem cells and corneal epithelial regeneration. Eye, 1994, 8:170-183.
[3] Pfister RR. Corneal stem cell disease: concepts, categorization and treatment by auto-and homo-transplantation of limbal stem cells. CLAO J, 1994, 20:64-72.
[4] Kruse FE, Tseng SC. A serum-free clonal growth assay for limbal, peripheral, and central corneal epithelium. Invest Ophthalmol Vis Sci, 1991, 32:2086-2095.
[5] Schermer A, Galvin S, Sun TT. Differentiation-related expression of a major 64K corneal keratin in vivo and in culture suggests limbal location of corneal epithelial stem cells. J Cell Biol, 1986, 103:49-62.
[6] 卢圣栋, 主编. 现代分子生物学实验技术. 北京: 高等教育出版社,1993. 403-406.
[7] Ebato B, Friend J, Thoft RA. Comparison of limbal and peripheral human corneal epithelium in tissue culture. Invest Ophthalmol Vis Sci, 1988, 29: 1533-1537.
[8] Kruse FE, Tseng SC. Growth factors modulate clonal growth and differentiation of cultured rabbit limbal and corneal epitheliun. Invest Ophthalmol Vis Sci, 1993, 34: 1963-1976.
[9] Kiritoshi A, SundarRaj N, Thoft RA. Differentiation in cultured limbal epithelium as defined by keratin expression. Invest Ophthalmol Vis Sci, 1991, 32:3073-3077.
(收稿:1998-04-13 修回:1998-09-10) 上一页 [1] [2] |
