|
2 结果
2.1 体外实验
LEC传代至第3~5代增殖最快,按1∶2分皿后约5天即可融合。传代至96孔板的细胞在8h内几乎完全贴壁,按3×104的细胞密度添加可在7~10天内达到融合。5-Fu作用不同时间对LEC增殖的抑制作用不同。A组中各质量浓度5-Fu对兔LEC均无明显抑制作用。B组中,质量浓度>80μg/ml可以抑制LEC增殖(P<0.001),在倒置显微镜下观察,发现细胞间彼此分离,终止抑制,换液培养后,有少数细胞尚可继续增殖。加入MTT后,变形的细胞几乎不着色,说明细胞已死亡;质量浓度达250μg/ml时,细胞边界消失,换液培养后,无细胞增殖,此质量浓度加入MTT后,细胞完全不着色。C组加药后,第7天观察到,药物质量浓度大于0.25μg/ml时,OD值与对照组间即有显著性差异(见表1);当质量浓度低于4μg/ml时,细胞形态无明显变化;当质量浓度达到8μg/ml时,可见细胞在皿底单个散在分布,呈不规则形,细胞边界呈波纹状,MTT染色,可以清楚地看到对照组,中间质量浓度组和高质量浓度组间细胞密度的差异。
表1 C组5-Fu作用7天的抑制效果 (n=8)
Tab.1 5-Fu inhibitory effect after 7-d reaction in group C(n=8)
|
5-Fu concentration
(μg/ml) |
OD value |
t value |
P value |
| 0 |
0.154 |
| 0.125 |
0.144 |
1.97 |
>0.05 |
| 0.25 |
0.137 |
4.84 |
<0.01 |
| 0.05 |
0.126 |
6.06 |
0.001 |
| 1 |
0.126 |
10 |
<0.001 |
| 2 |
0.13 |
2.64 |
<0.05 |
2.2 体内实验
各眼球角膜均发现炎性反应,有浆细胞和淋巴细胞浸润,且主要集中在角膜缘血管网周围,炎症的严重程度虽有不同,但都局限在角膜基质层的外1/5厚度内。前房注射5-Fu为0.5μg/ml时,角膜透明,角膜内皮细胞计数及六边形率大致正常,细胞形态无明显变化(见图1),角膜缘炎症为灶性,炎性细胞散在分布(炎性细胞计数见表2),虹膜基质偶见浆细胞浸润;质量浓度为5mg/ml时,角膜透明,内皮细胞计数及六边形率降低,细胞膜增厚,蛋白物质沉积,角膜缘炎症为小片状,淋巴细胞显著增多,虹膜及睫状体有炎性细胞散在分布;质量浓度为25mg/ml时,除上述改变外,可见角膜浸润、水肿及内皮细胞膜上串珠样蛋白物质沉积(见图2),角膜缘炎性细胞呈团状或带状密集分布,浆细胞显著增多,虹膜及睫状体可见灶性炎细胞浸润。
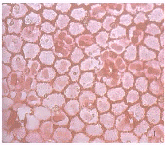 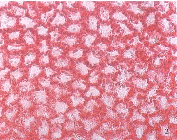
图1 0.5μg/ml5-Fu前房注射后角膜内皮细胞染色,细胞边界清晰 图2 25mg/ml5-Fu前房注射后角膜内皮细胞染色,细胞膜水肿,蛋白物质沉积 Fig.1 Rabbit corneal epithelial cells were stained after anterior chamber injection of 0.5μg/ml5-Fu,and the cell borders were clear Fig.2 Rabbit corneal epithelial cells were stained after anterior chamber injection of 25mg/ml5-Fu.Protein materials deposits on the edematous cell membrane
表2 不同质量浓度5-Fu前房注射后角膜缘炎细胞计数(n=10)
Tab.2 Inflammatory cell counting on the limbus of cornea
after anterior chamber injection of 5-Fu(n=10)
| 5-Fu concentration |
Plasmacyte |
Lymphocyte |
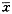 ±s ±s |
tvalue |
Pvalue |
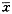 ±s ±s |
tvalue |
Pvalue |
| 0.5μg/ml |
8.8±5.3 |
|
|
27.4±14 |
|
|
| 5mg/ml |
9.5±3.2 |
0.08 |
>0.05 |
98±61 |
4.39 |
<0.05 |
| 25mg/ml |
12.7±3.4 |
4.29 |
<0.01 |
97±68 |
3.87 |
<0.01 |
上一页 [1] [2] [3] 下一页 |
